米国食品医薬品局(FDA)がアルツハイマー病を治療するために物議を醸している薬に青信号を出した約1年後、議員はその承認に至ったプロセスを修正しようとしています。
医薬品の安全性と生物医学研究を監督する下院エネルギー・商業委員会は先週、企業が治療に関する追跡調査を妥当な量で完了できなかった場合、承認の加速を取り消す権限をFDAに与えることを望んでいると発表しました。時間。
FDAの資金提供再承認法案の一部として導入されたこの規定は、9月より前に可決される可能性があり、2021年に当局がアデュカヌマブを承認した直後に行われました。アルツハイマー病の進行。 独立した専門家委員会による承認にほぼ全会一致で反対票を投じたにもかかわらず、この機関はマサチューセッツ州ケンブリッジに本拠を置くバイオテクノロジー企業であるBiogenによって開発されたこの薬を迅速に追跡しました。 3人の諮問委員会メンバーが決定に抗議して辞任し、承認は連邦規制当局による複数の調査の対象となっています。
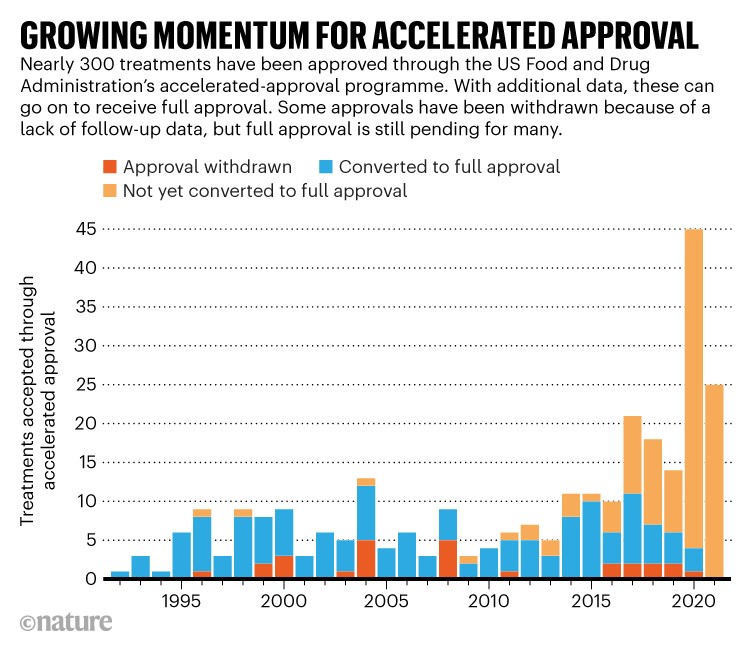
この薬剤承認経路が発火している理由はアデュカヌマブだけではありません。このプログラムは、開始以来、過去10年間だけで約3分の2を占める、279の治療薬が市場に出回っています(「迅速承認のための勢いを増す」を参照)。 ‘)。 このプログラムの人気の高まりは、当初の意図からの転換を示していると、ワシントンDCの非営利団体である国立健康研究センターのダイアナズッカーマン会長は述べています。 「迅速承認は少数の薬剤のための特別なプログラムとして始まりました、そして今ほとんどの癌治療薬は加速されたまたは他の何らかの促進された経路を通過しています」と彼女は言います。
さらに、企業は、承認プロセスの一環として約束された追跡調査の作成に時間がかかっています。 FDAは、データの提供を強制する権限が限られていますが、下院と上院を通過する際に大幅に変更される可能性のある立法案は、それを行うためのより多くの権限を与える可能性があります。
2月の任命の数日前に、FDAのコミッショナーであるロバート・カリフは、迅速承認改革を当局の優先事項にすることを約束しました。 に話しかけた研究者 自然 プログラムの完全性を保護するために改革が必要であり、提案された法案は良いスタートであることに同意します。 しかし、彼らはまた、製薬会社が市場へのこのルートを悪用することをさらに防ぐであろう、より多くの代理店の監視および他の変更を推奨しました。
「製薬会社が意図したとおりに迅速承認経路を採用していることを確認するために努力しているのではなく、彼らが見つけることができる抜け穴を利用することをいとわない人が多すぎます」と社長のデビッド・ミッチェルは言いますワシントンDCの非営利団体であるPatientsforAffordable Drugsは、FDAの抗がん剤を審査する独立委員会の消費者代表を務めています。
スピードの必要性
FDAは、主にHIV-AIDS危機に対応して、緊急に必要な医薬品を遅滞なく市場に出すために、1992年に迅速承認経路を作成しました。 患者の生存や症状の軽減など、臨床的に意味のあるエンドポイントを通じて有効性を示す代わりに、この経路でレビューされる薬剤候補は、従来の臨床試験エンドポイントよりも追跡が高速または容易なサロゲートエンドポイントと呼ばれるものに依存することがよくあります。 たとえば、腫瘍の縮小は、がん治療薬の臨床試験で使用される一般的な代理ですが、この測定基準は必ずしも患者への直接的な利益に関連しているわけではありません。
コネチカット州ニューヘブンにあるイェール大学の疫学者でありグローバルヘルスの専門家であるグレッグゴンザルベスは、FDAにこのプログラムを採用するよう説得したグループの1つでした。 「人々が死にかけているので、私たちはこの迅速承認経路を推進しました」と彼は言います。 「私はHIV陽性なので、絶望と希望が必要です。」
この経路は、市場に出回っている免疫療法と癌治療の数を押し上げています。 しかし、これらの薬のいくつかは、多くの場合、それらの臨床的有用性を示す限られたデータにもかかわらず、年間数十万ドルの費用がかかります。 Gonsalvesは、このプログラムは承認を迅速化するために製薬業界によって採用されたと主張しています。 この経路で承認されたがん治療は、標準的な経路よりも平均して約3年早く市場に出回っています。 そして、代理エンドポイントを使用した単一の研究は、市場で治療を受けるのに十分である可能性があります。
問題の一部は、メリーランド州ボルチモアにあるジョンズホプキンスブルームバーグ公衆衛生大学院の内科専門医および疫学者であるカレブアレクサンダーは、製薬会社が市場後のタイムリーな調査で交渉の終わりを支持していないことであると述べています薬の利点。 一部の研究者は、企業がそのようなデータを作成するのに時間がかかりすぎるかどうかを疑問視しています。 A 2021年の分析 1992年から2016年の間に迅速承認を与えられた医薬品の13%が、5年以内に完全承認に変換されておらず、変換に必要なデータなしで中央値9。5年間市場に残っていることがわかりました。
FDAは、アデュカヌマブの確認試験を完了するためにバイオジェンに9年間の猶予を与えました。これは、アレクサンダーが「率直に言って攻撃的」と呼んでいるタイムラインです。 バイオジェンはそれ以来、4年以内に試験を完了すると述べており、同社のスポークスパーソンは、試験のデータ(まだ公開もピアレビューもされていない)は、薬を服用している一部の人々の臨床的衰退が鈍化していることを示していると述べています。
市販後の試験は、特に神経変性疾患などの進行の遅い状態では、長い時間がかかる可能性があると、21の製薬会社を代表するワシントンDCの組織であるRare DiseaseCompanyCoalitionの広報担当者は述べています。
また、企業が参加者を募集することも困難です。なぜなら、人々はプラセボを入手するリスクよりも、承認された薬が保証されることを望んでいるからです。 完全承認に変換されていない薬の販売をやめるように会社に要求する代わりに、代理店は会社が自主的にそれを市場から撤退することをしばしば要求する、とZuckermanは言います。 「製品が承認されると、FDAは莫大なレバレッジを失います」とアレクサンダーは言います。
たとえば、2011年に、FDAは、臨床的利益の欠如を理由に、乳がんを治療するための抗体薬ベバシズマブの迅速承認を取り消しました。 これは、乳がんの人々が承認を維持しようとして感情的な証言をしたため、国民の反発をもたらしました。 コネチカット州ダンベリーにある非営利団体であるNationalOrganizationforRare Disordersは、多くの人にとって、迅速承認は「貴重な希望の源」であると述べています。 2021年のレポートで。 しかし、多発性骨髄腫を患っているミッチェルは、次のように主張しています。 希望は私を生かし続けるものではありません。 安全で効果的なのは薬です。」
FDAのスポークスパーソンであるJeremyKahnは、迅速承認プログラムの完全性を確保することを当局が約束していることを電子メールで確認し、深刻な疾患の治療選択肢がない人々は「ある程度の不確実性を受け入れる」ことをいとわないと述べた。新しい治療法の臨床的利益。 臨床的利益は、加速された承認の大部分で確認されていると彼は付け加えた。
ルールの変更、同じ問題
迅速承認プログラムは、他の国々のモデルとして役立ってきました。 しかし、欧州連合や日本を含む採用者は、麻薬規制当局により多くの権限を与えています。 規制当局は、企業に対して、設定された期間内に確認試験からのデータを提出するよう要求することができます。 そうでない場合は、承認を取り消すことができます。
米国FDAに対して提案された規則の変更がどれほど効果的であるかは不明です。 代理店が承認を取り消すのは簡単になりますが、承認を取り消す官僚的なプロセスも長くなります。 これは規定を覆すものだ、とザッカーマンは言う。 彼女は、確認試験が1年遅れると、承認を自動的に取り消すという以前の提案に固執することを望んでいたでしょう。
Zuckermanはまた、FDAコミッショナーのオフィスが、アデュカヌマブで起こったように、諮問委員会の勧告に反する機関の承認を検討するために、別個の独立した諮問グループを作成することを推奨しています。 「諮問委員会の投票の大多数は承認を推奨しているので、承認を推奨しない場合、通常は本当に正当な理由があります」と彼女は言います。
アレクサンダーは、レバレッジとしてヘルスケアカバレッジを使用することを提案しています。 たとえば、ボルチモアにある米国メディケア&メディケイドサービスセンター(CMS)は、数千万人の米国居住者にどの治療に資金を提供するかを決定します。 今年初め、アデュカヌマブの有効性を懸念して、CMSは、臨床試験に登録された人々に対してのみ、薬剤の年間28,800米ドルの費用をカバーすると述べました。
その決定はほとんど前例のないものですが、Alexanderは、CMSは、まだ完全承認を得ていない他の迅速承認治療に対して、より低い償還率を検討する必要があると考えています。 そのような動きは、彼らの試験を完了するために「製造業者の下で火をつける」かもしれないと彼は言います。 「薬の安全性と有効性の全容がわからないのに、なぜ納税者は薬の全額を支払うことに夢中になっているのでしょうか?」 彼は尋ねます。
しかしミッチェルは、償還を削減することで、命を救う可能性のある医薬品を製造するという企業のインセンティブが失われるのではないかと心配している。 彼は、骨髄腫の診断後も彼を生かしておくために、3つの迅速承認薬を認めています。
ミッチェルは、アデュカヌマブの大失敗を承認の加速という壮大な計画の「ブリップ」と見なしていますが、一部の薬剤の確認試験の必要性により多くの注目を集めていると述べています。 改革は簡単ではありません。 薬が市場に出ると、ミッチェルは「製薬会社はそれを取り除く理由を見つけることを切望していません」と言います。
それでも、多くの研究者や医薬品安全の擁護者は変化を見たいと熱望しています。 「私たちは、一方向に遠すぎる振り子を修正しようと試み始めました。そして、今、この方向にどれだけ進んでいるかを見てください。」とZuckermanは言います。
The post FDAは、アルツハイマー病の大失敗に続いて、薬を精査する方法を変更しますか? appeared first on Gamingsym Japan.